HOME > 有機化学 > ホモカップリング反応 > ピナコールカップリング
ピナコールカップリングとは
ピナコールカップリングとは、2分子のアルデヒドまたはケトンをマグネシウムなどの還元剤で処理してカルボニル基間に炭素-炭素結合が形成されたビシナルジオールを得るホモカップリング反応であり、1859年にヴィルヘルム・ルドルフ・フィッティッヒによって発見された
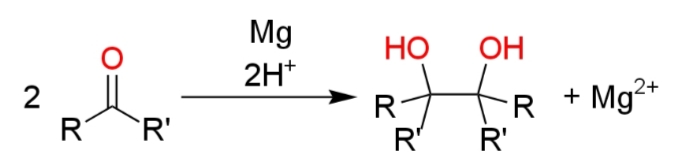
反応名の由来はアセトンを用いた際に生成するピナコール (2,3-ジメチル-2,3-ブタンジオール)である。
アルデヒドやケトンは反応性が高いため、マグネシウムなどでもホモカップリングを起こすが、エステルは反応性が低いため、金属ナトリウムを用いなければホモカップリング(アシロイン縮合)は進行しない。
反応機構
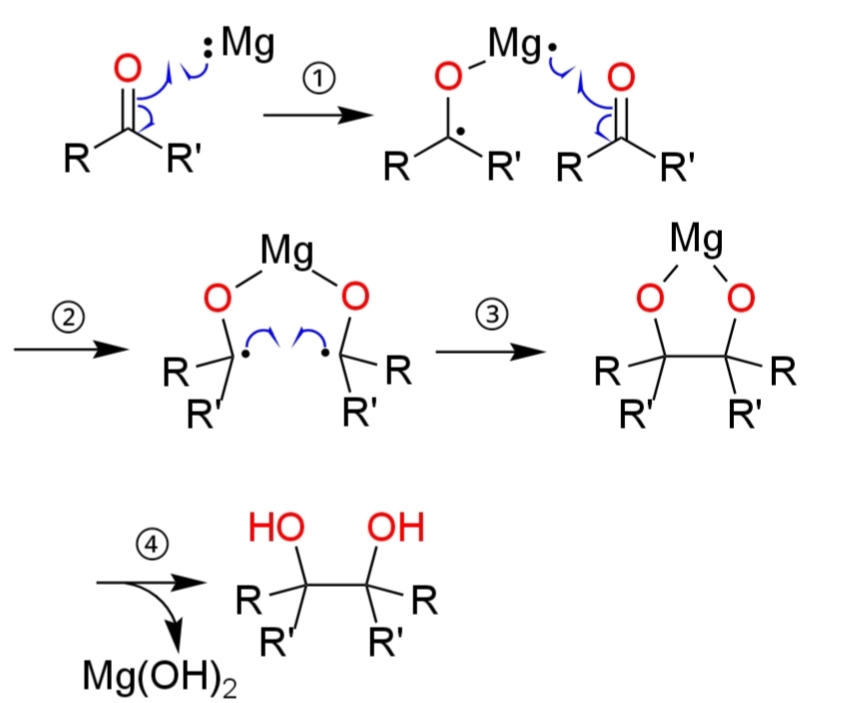
①1電子移動(SET)
初めに、マグネシウムMgによってカルボニル基がラジカル開裂し、ケチルラジカルが生成する。
②1電子移動(SET)
もう1分子のカルボニル基もラジカル開裂し、ケチルラジカルが生成する。
③ホモカップリング反応
2つのケチル基がホモカップリングし、2つのヒドロキシ基が脱プロトン化されたビシナルジオールが得られる。
④後処理
水または酸を加えることによって、ジオールが得られる。
適用範囲
アルデヒドまたはケトンR-CO-R’
還元剤としてマグネシウムを用いている場合、基質にハロゲンが存在しているとグリニャール試薬調製反応が起きてしまうため不適である。そのほかの基質は使用できるため、 基質の適用範囲は広い。
還元剤
還元剤としては、マグネシウムのほか、マンガンやヨウ化サマリウム(II)、亜鉛/四塩化チタン、マグネシウム/四塩化チタンなどを用いることができる。
溶媒
有機金属中間体が溶媒和するようにエーテル系の溶媒、特にTHF がよく用いられる。また、HMPAなどの強ドナー 性溶媒を少量添加するとケチルラジカルが安定化され、反応速度を加速させることができる。
反応条件
還元剤が失活しないように脱気・脱水条件で反応を行なう。亜鉛/四塩化チタンやマグネシウム/四塩化チタンを用いる際には、反応温度が高いとマクマリーカップリングまで進行してアルケンとなってしまうため、0°C以下の低温で反応を行なった方が良い。
応用例
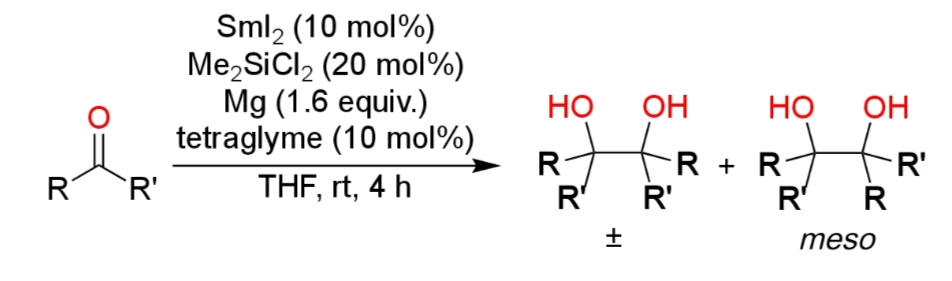
ヨウ化サマリウムを用いた反応
サマリウム塩はキレートを作りやすいため、ヨウ化サマリウムを用いて反応を行なうと高い立体選択性をもつ生成物が得られる(iii)。
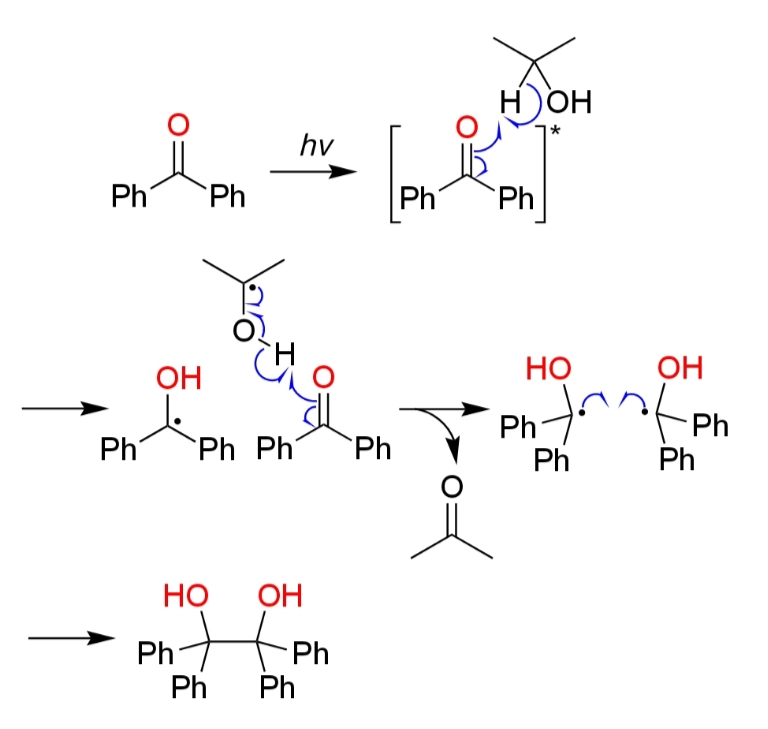
光化学的反応
ベンゾフェノンはイソプロパノール溶媒中で紫外線を受けると金属還元剤無しでピナコールカップリングが進行する。反応機構としては、初めにベンゾフェノンが紫外線を受けると一重項励起状態になり、さらに三重項状態への項間交差が起こった後、溶媒のイソプロピルアルコールを還元剤としピナコールカップリングが起きてベンゾピナコールが得られる(iv)。
全合成への応用
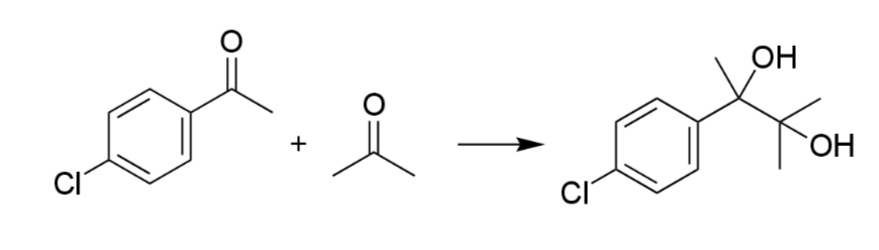
一般的に二種類のアルデヒドまたはケトンを用いると、ホモカップリング体とクロスカップリング体の混合物となるため、クロスカップリングは難しい。例えば、p-クロロアセトフェノンとアセトンのピナコールカップリングでは クロスカップリング体のフェナグリコドールは40%しか得られない。
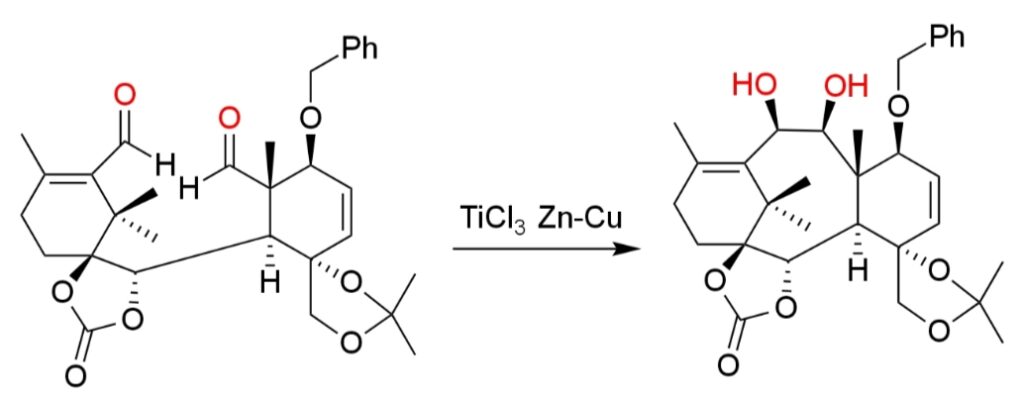
しかし、環化反応にはピナコールカップリングを用いることができ、タキソールの全合成などに使われている(v)。
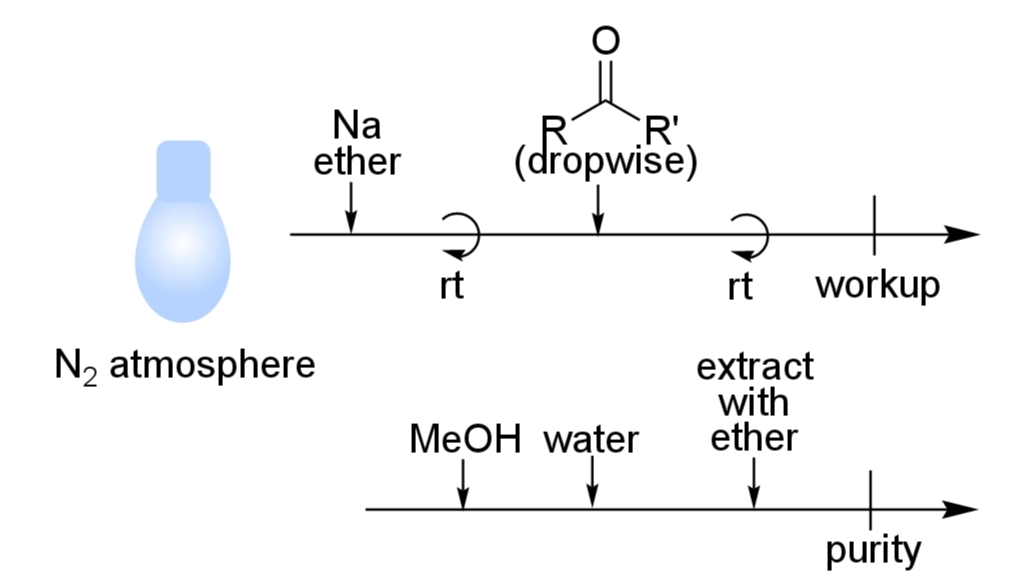
実験手順
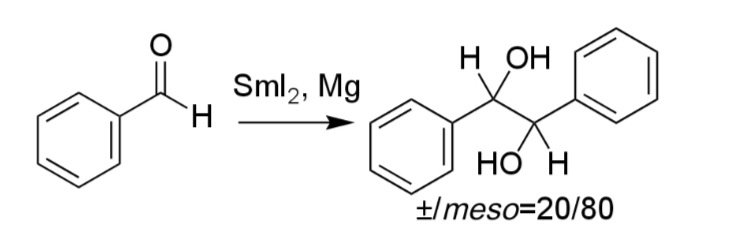
反応例
ベンズアルデヒドを反応をさせると1,2-ジフェニル-1,2-エタンジオールが得られる(iii)。
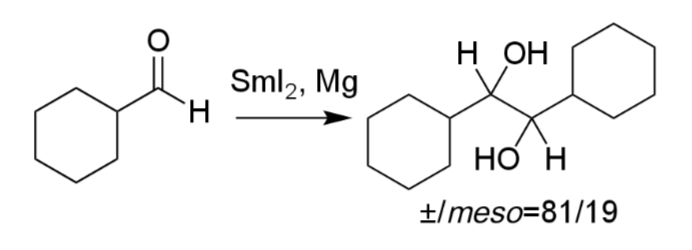
シクロヘキサンカルボアルデヒドを反応をさせると1,2-ジシクロヘキシル-1,2-エタンジオールが得られる(iii)。
開連反応
・ブーボー・ブラン還元
参考文献
(i) Fittig, R. Ann. 1859, 110, 17.
(ii) Fittig, R. Ann. 1859, 110, 23.
(iii) Aspinall, H. C.; Greeves, N.; Valla, C. Org. Lett. 2005, 7, 1919-1922.
(iv) Bachmann W. E. Org. Synth. 1943, 2, 71.
(v) Nicolaou, K. C.; Liu, J. J.; Yang, Z.; Ueno, H.; Sorensen, E. J.;Claiborne, C. F.; Guy, R. K.; Hwang, C. K.;Nakada, M.; Nantermet, P. G. J. Am. Chem. Soc. 1995, 117, 634-644.
HOME > 有機化学 > ホモカップリング反応 > ピナコールカップリング
