HOME > 有機化学 > クロスカップリング反応(炭素-炭素) > 熊田-玉尾-コリューカップリング
【前ページ】 【次ページ】
熊田-玉尾-コリューカップリングとは
熊田-玉尾-コリューカップリングとは、ニッケルまたはパラジウム触媒存在下で、芳香族またはアルケニルハロゲン化物R-Xと脂肪族または芳香族グリニャール試薬R’-MgX’とから炭素-炭素カップリング体R-R’を得るクロスカップリング反応であり、1972年に、熊田、玉尾らの研究グループと、コリューらの研究グループによってそれぞれ独立に開発された。熊田-玉尾カップリング、熊田-コリューカップリング、熊田カップリングとも呼ばれる(i)(ii)(iii)。

反応機構
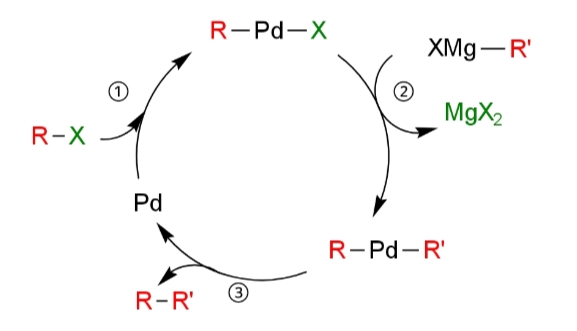
①酸化的付加
はじめに、酸化的付加によって電子豊富な0価のパラジウム触媒がハロゲン化物のR-X結合に挿入されて、有機パラジウム錯体が形成される。
②トランスメタル化
グリニャール試薬R’-MgX’の炭素基R’が有機パラジウム錯体上の配位子と交換してトランスメタル化する。
③還元的脱離
最後に、還元的脱離によって炭素-炭素結合R-R’が生成する。ニッケル触媒を用いた際も似たような反応機構になると考えられている。
適用範囲
ハロゲン化試薬R-X
ハロゲン化アリールやハロゲン化ビニルを用いることができ、ハロゲン以外にトシラートやトリフラートを用いることもできる。ハロゲンとしてはヨウ化物や臭化物を使うことができるが、塩化物はほとんど反応が進行しない。
ハロゲン化アルキルを用いた際、β水素の存在によって脱離反応が競合するため、一般的に収率は低い。また、グリニャール試薬と反応してしまう官能基を持つ化合物は使用できない。その場合は、グリニャール試薬よりも反応性の低い有機亜鉛化合物を用いた根岸カップリングなどが選択肢として挙がる。
グリニャール試薬R’-MgX’
アルキルグリニャール試薬はβ水素脱離を起こさないため、アリールグリニャール試薬だけでなくアルキルグリニャール試薬も用いることができ、様々な構造のものが使用できる。
触媒
パラジウム触媒としては、0価のPd(PPh3)4やPd(P(t-Bu)3)4 、[Pd(dba)2]など、2価の[Pd(OAc)2]や[Cl2Pd(PPh3)2] 、[Pd(dppe)Cl2]、[Pd(dppp)Cl2]などが用いられる。また、ニッケル触媒としては、0価の[Ni(PCy3)2]や、2価の[Ni(MeCN)2Cl2]、[NI(dppe)Cl2]などが用いられる。2価のパラジウムまたはニッケルの場合は、グリニャール試薬のトランスメタル化およびホモカップリングによって0価のパラジウムまたはニッケルが生じる。
溶媒
グリニャール試薬はプロトン性溶媒と反応するため、溶媒としては、グリニャール試薬を安定化させる効果もあるTHFやジエチルエーテルなどもエーテル系溶媒が用いられる。遷移金属触媒は空気や水分に敏感なため、溶媒は脱水&脱気条件である必要あり。
反応条件
脱水&脱気条件で行なう。
前身の反応
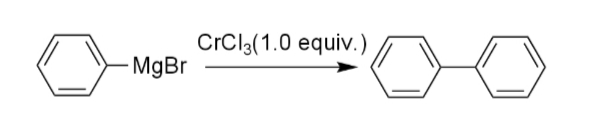
古くから、グリニャール試薬を用いるカップリングは知られていたが、化学量論的な金属塩を必要としていた。例えば、1914年にターナーはグリニャール試薬のホモカップリング反応を報告したが、化学量論量の塩化クロム(III)を必要としていた。また、ギルマンは同様の反応が塩化ニッケル(II)、塩化コバルト(II)、塩化銀(I)を用いた際にも進行することを報告していた(iv)。
また、1940年代にカラッシュはグリニャール試薬とハロゲン化アリールまたはハロゲン化ビニルを用いた塩化コバルト(II)触媒存在下におけるクロスカップリング(v)、1971年に高知らは銀触媒存在下におけるクロスカップリング(vi)を報告した。
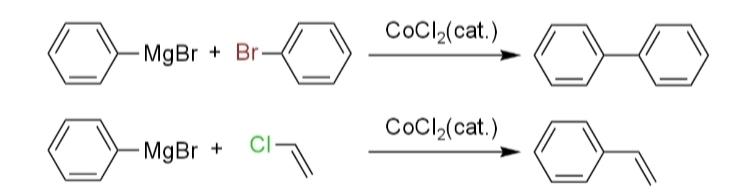
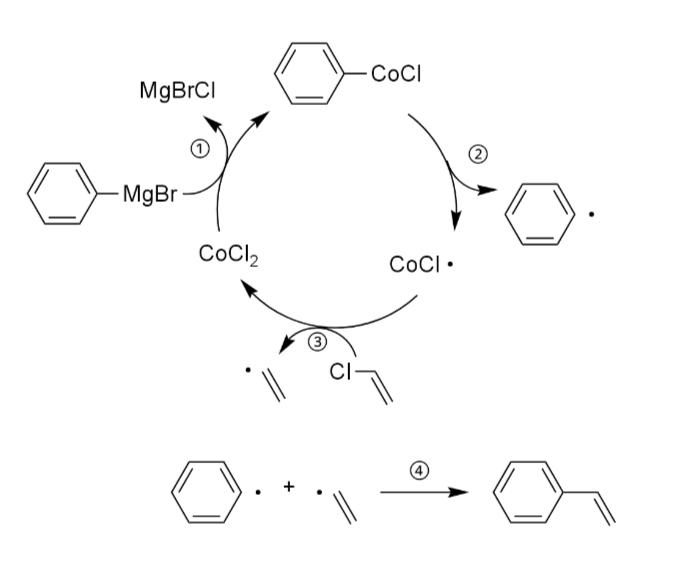
しかし、どちらの反応もラジカル的に進行し、ホモカップリング体の形成によって収率は高くなかった。
一方、同年の1971年に高知らは、銅触媒(vii)や鉄触媒(viii) を用いた高知-フュルスナーカップリングではクロスカップリング体が多く得られたことを確認し、それらの反応機構はラジカル的に進行しているとは考えられず、本反応と同様に、近代的なクロスカップリングの先駆けとなった。
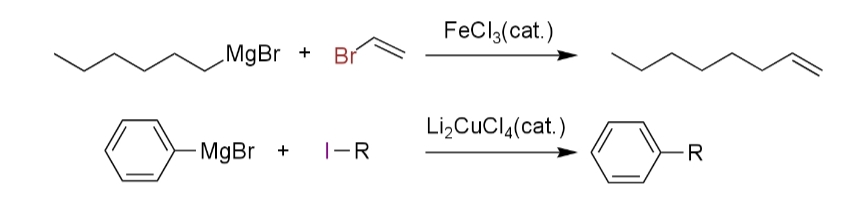
高知らの報告した銅触媒および鉄触媒を用いたクロスカップリングでは、基質がハロゲン化ビニルに限定されていたが、翌年の1972年に熊田、玉尾らの研究グループと、コリューらの研究グループは、ニッケル触媒を用いることによってハロゲン化ビニルだけでなくハロゲン化アリールも用いることができると報告した(i)(iii)。
さらに、1975年には、村橋らによってパラジウム触媒を用いた反応が報告され、基質適用範囲はより広がった(ix)。
選択性
立体選択性
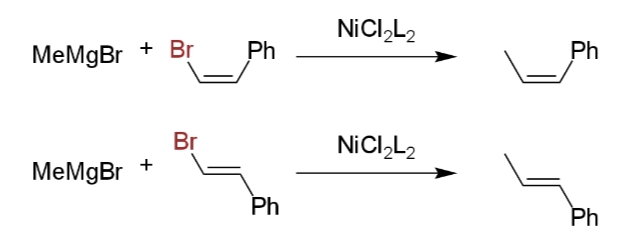
シスオレフィンハロゲン化物とトランスオレフィンハロゲン化物は両方とも、アルキルグリニャール試薬と反応すると、立体配置を保持する(ii)。これは触媒配位子やビニル置換基などとは無関係である。
逆に、アルケニルグリニャール試薬を用いた場合は、立体は保持されず、シスアルケンとトランスアルケンの混合物となる。
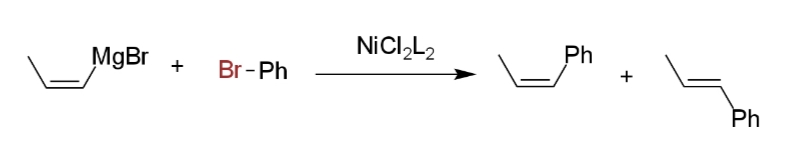
これは、アルケニルグリニャール試薬がニッケルまたはパラジウム錯体にπ配位して、異性化してしまうためである(ii)。
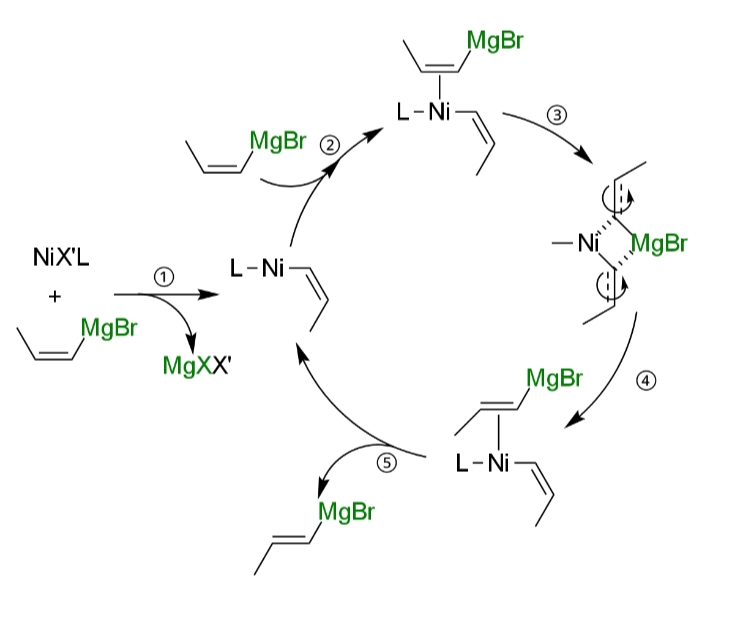
そのため、反応相手のハロゲン化物の反応性が高く、アルケニルグリニャール試薬の添加量が少ないほど、アルケニルグリニャール試薬が配位する機会が減り、立体選択性は高くなる(x)。
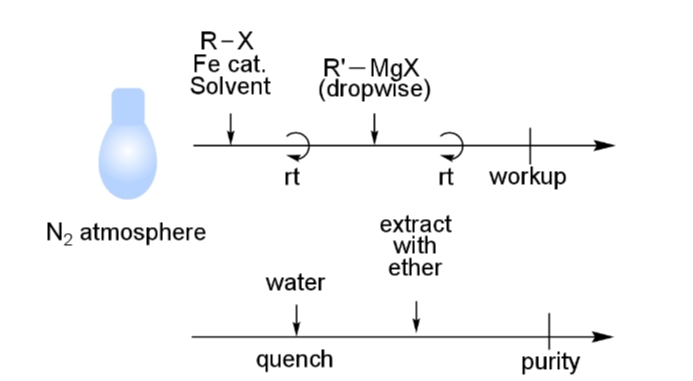
実験手順
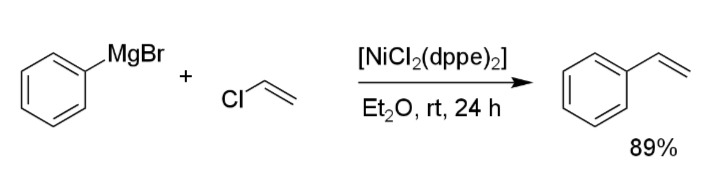
反応例
フェニルグリニャール試薬とクロロビニルを反応させるとスチレンが得られる(i)。
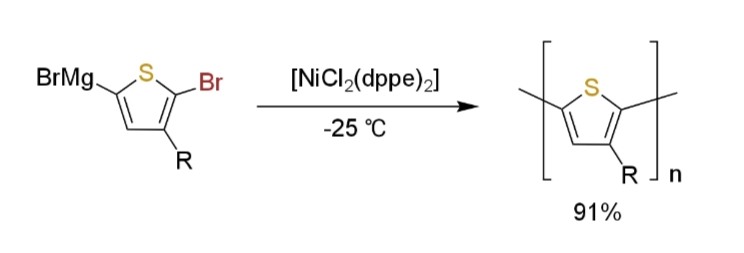
ブロモチオフェンのグリニャール試薬を反応させるとポリチオフェンが得られる(xi)。
参考文献
(i) Tamao, K.; Sumitani, K.; Kumada, M. J. Am. Chem. Soc. 1972, 94, 4374-4376.
(ii) Kumada, M. Pure Appl. Chem. 1980, 52, 669.
(iii) Corriu, R. J. P.; Massse, J. P. J. Chem. Soc., Chem. Commun. 1972, 144.
(iv) Gilman H J. Am. Chem. Soc.1939,61 957-959.
(v)Kharasch, M. S.; Fields, E. K. J. Am. Chem. Soc. 1941, 63, 2316–2320.
(vi)Kochi, J. K.; Tamura. M. J. Am. Chem. Soc. 1971, 93, 1483–1485.
(vii) Kochi, J. K.; Tamura, M. J. Am. Chem. Soc. 1971, 93, 1485–1487.
(viii)Tamura, M.; Kochi, J. K. J. Am. Chem. Soc. 1971, 93, 1487–1489.
(ix) Yamamura, M.; Moritani, I.; Murahashi, S. J. Organomet. Chem. 1975, 91. C39–C42.
(x) Kumada, M. Pure Appl. Chem.1980, 52, 669-679.
(xi) Cheng, Y. J.; Yang, S. H.; Hsu, C. S. Chemical Reviews. 2009,109, 5868–5923.
【前ページ】 【次ページ】
HOME > 有機化学 > クロスカップリング反応(炭素-炭素) > 熊田-玉尾-コリューカップリング
